Interview mit Paul Nghiem, MD, PhD
 Mark Teich, Chefredakteur der „Skin Cancer Foundation“, sprach mit Paul Nghiem, MD, PhD, über die jüngsten Fortschritte bei der Diagnostik, Nachsorge und Behandlung von Patienten mit einem Merkelzell-Karzinom (MCC). Das Merkelzell-Karzinom ist ein seltener, aber gefährlicher Hauttumor. Dr. Nghiem (ausgesprochen NEE-em) hält den George F. Odland Stiftungslehrstuhl inne und ist Leiter der Dermatologie der University of Washington in Seattle. Er ist einer der führenden Experten für Merkelzell-Karzinom in den USA.
Mark Teich, Chefredakteur der „Skin Cancer Foundation“, sprach mit Paul Nghiem, MD, PhD, über die jüngsten Fortschritte bei der Diagnostik, Nachsorge und Behandlung von Patienten mit einem Merkelzell-Karzinom (MCC). Das Merkelzell-Karzinom ist ein seltener, aber gefährlicher Hauttumor. Dr. Nghiem (ausgesprochen NEE-em) hält den George F. Odland Stiftungslehrstuhl inne und ist Leiter der Dermatologie der University of Washington in Seattle. Er ist einer der führenden Experten für Merkelzell-Karzinom in den USA.
Frage: An einem Melanom, schwarzer Hautkrebs, sterben mehr Menschen als an jedem anderen Hautkrebs. Obwohl das Merkelzell-Karzinom (MCC) viel seltener ist als das Melanom, ist es deutlich gefährlicher. Was macht es so gefährlich?
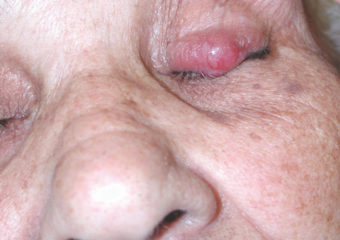
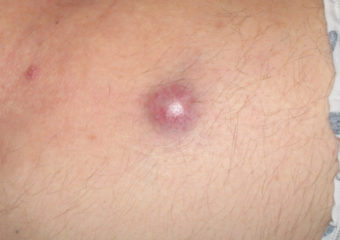
Antwort: In der Regel sind Merkelzell-Karzinome in einem frühen Stadium klinisch deutlich weniger auffällig als frühe Melanome. Sie sehen nicht beunruhigend aus, so dass sie letztendlich oft erst in einem fortgeschrittenen Stadium erkannt werden. Und zwar dann, wenn sich bereits Tochtergeschwülste (Metastasen) in anderen Organen gebildet haben und eine Behandlung deutlich schwieriger ist. Im Gegensatz dazu werden viele Melanome in einem sehr frühen Stadium (Stadium 0) als Melanoma in situ diagnostiziert. Zu diesem Zeitpunkt ist das Melanom auf die obere Schicht der Haut (Epidermis) begrenzt und noch nicht in die tieferen Schichten der Haut eingedrungen. Melanoma in situ sind einfach zu behandeln und metastasieren praktisch nie. Aus den mehr als 1.000 Fällen von Merkelzell-Karzinomen, die wir untersucht haben gab es nur zwei in situ Merkelzell-Karzinome. Es ist sehr selten, dass Merkelzell-Karzinome zu einem so frühen Zeitpunkt bereits erkannt werden.
Wenn man ein Melanom oder ein Merkelzell-Karzinom diagnostiziert, besteht die anfängliche Sorge darin, dass sich bereits Tumorzellen vom Primärtumor bis zur nächsten Lymphknotenstation ausgebreitet haben. Um dies zu überprüfen, ist das heutige Standardverfahren die Sentinel-Lymphknoten-Biopsie (SLNB). In diesem diagnostischen Verfahren wird untersucht, ob sich Tumorzellen auf die ersten drainierenden Lymphknoten ausgebreitete haben. Hierfür werden die ersten Lymphknoten der regionalen Lymphknotenstation, die die Lymphflüssigkeit aus dem Gebiet des Primärtumors drainieren, operativ entfernt und anschließend mikroskopisch untersucht. Die meisten Melanome werden in einem frühen Stadium diagnostiziert und aufgrund der geringen Tumordicke ist eine solche Sentinel-Lymphknoten-Biopsie nicht notwendig, da eine Metastasierung sehr unwahrscheinlich ist. Hingegen besteht bei sehr kleinen Merkelzell-Karzinomen, klinisch vier oder fünf Millimeter im Durchmesser, bereits eine 15-prozentige Chance einer Ausbreitung von Tumorzellen in die Lymphknoten oder darüber hinaus. Deshalb sollte auch bei sehr kleinen Merkelzell-Karzinomen eine SLNB erwogen werden.
Frage: Was kann man tun, um mehr von diesen frühen Läsionen zu entdecken, wenn sie noch leicht zu behandeln sind? Wie kann man mögliche Merkelzell-Karzinome früher erkennen?
Antwort: Die klassischen ABCDE-Regel, die beim Melanom angewandt wird, ist beim Merkelzell-Karzinom nicht anwendbar. Stattdessen haben wir das Akronym AEIOU, das bei der frühen Diagnostizierung helfen kann: Asymptomatisch / schmerzlos; Expanding rapidly /schnell wachsend; Immunsuppression; Older/ älter als 50 Jahre; UV-Exposition / helle Haut. Etwa 63 Prozent der Merkelzell-Karzinom-Patienten haben schnell wachsende Läsionen und bei nahezu 90 Prozent treffen drei oder mehr Punkte der AEIOU-Regel zu. Es ist wichtig zu beachten, dass viele Läsionen bei denen mehrere Punkte der AEIOU-Regel zu treffen, keine Merkelzell-Karzinome sind. Manche sind gutartig und hinter anderen können weitere Hautkrebsarten stecken.
Frage: Wie sind die Überlebenschancen für Patienten, wenn ein Merkelzell-Karzinom bereits Lymphknotenmetastasen oder Organmetastasen entwickelt hat?
Antwort: Das ist aktuell schwierig zu sagen, da sich das Überleben aufgrund von neuen Therapien in kurzer Zeit deutlich zum Besseren verändern wird. Ich fühlte mich in der Vergangenheit hilflos, wenn ein Patient ein metastasiertes Merkelzell-Karzinom entwickelt hat, aber zum jetzigen Zeitpunkt ist es nicht mehr hoffnungslos. Es gab große Veränderungen in diesem Bereich mit einer echten Chance auf eine Heilung oder eine „nahezu-Heilung“ beim fortgeschrittenen Merkelzell-Karzinom. Ich stelle fest, dass mindestens 50 Prozent der Patienten mit metastasiertem Merkelzell-Karzinom wirksam behandelt werden können.
Frage: Welche Therapie haben diese Veränderung gebracht?
Antwort: In der Vergangenheit haben wir fortgeschrittene Merkelzell-Karzinome mit Chemotherapien behandelt. Durch diese verkleinern sich die Tumore in mehr als 50 Prozent der Fälle, aber das Therapieansprechen hält durchschnittlich nur über drei Monate an. Wenn der Krebs erneut zurückkehrte, zeigte er sich gegen viele Medikamente resistent. Zudem wurde das Immunsystem durch die Chemotherapie geschädigt, dies sind erschwerende Probleme für einen sehr immun-sensitiven Krebs. Checkpoint-Inhibitoren sind eine spannende neue Klasse von Immuntherapien (Behandlungen, die die Fähigkeit des eigenen Immunsystems zur Bekämpfung einer Krankheit steigern) und stellen bald den Goldstandard der Therapie für das metastasierte Merkelzell-Karzinom dar. Durch die Blockierung von Rezeptoren, die normalerweise das Immunsystem in Schach halten, stimulieren diese Medikamente T-Zellen, um den Tumor zu bekämpfen. Im Jahr 2014 wurde der Checkpoint-Inhibitor namens Pembrolizumab (Keytruda) für Patienten mit einem metastasierten Melanom zugelassen und bei vielen Patienten konnte eine langfristige Remission der Tumorerkrankung erreicht werden. Pembrolizumab blockiert das Zusammenspiel zwischen dem Rezeptorprotein namens PD-1 (programmierter death-1) und seinem immunhemmenden Liganden. Aktuell wird es beim Merkelzell-Karzinom erfolgreich im off-label-use (ein bereits zugelassenes Medikament wird für eine andere Erkrankung verwendet, für die es nicht zugelassen ist) in klinischen Studie verwendet, um nach Auswertung der Daten eine Zulassung der Immuntherapie für das Merkelzell-Karzinom zu erhalten. Es ist anzumerken, dass bisher kein einziges Medikament von der US Food & Drug Administration (FDA) für die Behandlung des Merkelzell-Karzinoms zugelassen worden ist.
Des Weiteren wird die Wirksamkeit des neuen Checkpoint-Inhibitors Avelumab bei Patienten mit einem fortgeschrittenen Merkelzell-Karzinom untersucht. Dieser stimuliert T-Zellen, in dem er das Molekül PD-L1 blockiert, welches mit PD-1 zusammen Immunzellen hemmt.Verschiedene klinische Studien werden mit den einzelnen Medikamenten bei Patienten mit Merkelzell-Karzinom aktuell durchgeführt. Basierend auf den bisherigen Ergebnissen werden diese Medikamente zunehmend verfügbar sein. Im Jahr 2015 bewilligte die FDA dem Checkpoint-Inhibitor Avelumabden „fast track“ und „breakthrough therapy“-Status, hierdurch wird der Zulassungsprozess der zu erwarteten FDA-Zulassung beschleunigt.
Wir gehen davon aus, dass sowohl Pembrolizumab als auch Avelumab im Jahr 2017 die Zulassung für die Indikation des fortgeschrittenen Merkelzell-Karzinoms erhalten. Es kristallisiert sich zunehmend heraus, dass die Patienten von diesen Immuntherapien wesentlich mehr profitieren und sie deutlich besser vertragen werden als die bisher verwendeten Chemotherapien.
„Ich fühlte mich in der Vergangenheit hilflos, wenn ein Patient ein metastasiertes Merkelzell-Karzinom entwickelt hat, aber zum jetzigen Zeitpunkt ist es nicht mehr hoffnungslos.”
Frage: Welches der beiden Medikamente zeigt die besten Ergebnisse?
Antwort: Hierzu kann man aktuell keine Aussage machen, da diese beiden Medikamente bei verschiedenen Patientengruppen untersucht wurden (die Patienten mit Pembrolizumab hatte keine vorherige Chemotherapie erhalten, die Patienten mit Avelumab hatten vorher eine Chemotherapie unter der die Tumorerkrankung fortgeschritten ist). Beide Medikamente blockieren den gleichen Mechanismus, um T-Zellen zu stimulieren. Daher gibt es zum jetzigen Zeitpunkt keinen klaren Unterschied in der Wirksamkeit der beiden Medikamente.
Frage: Gibt es aktuell eine bestimmte Reihenfolge, in der die Therapien gegeben werden sollten? Müssen Sie zuerst eine Chemotherapie oder Strahlung durchführen, bevor Sie eine Therapie mit den Checkpoint-Inhibitoren einleiten dürfen?
Antwort: Bis vor kurzem war die Chemotherapie die Erstlinientherapie. Patienten, die direkt mit einem Checkpoint-Inhibitor behandelt wurden, ohne vorherige Chemotherapie, haben mit 60 Prozent ein gutes Therapieansprechen. Wenn es nach einer Erstlinientherapie mit einer Chemotherapie zu einem Progress der Tumorerkrankung kam und im Anschluss eine Therapie mit einem Checkpoint-Inhibitor stattgefunden hat, scheinen nur etwa 40 Prozent der Patienten von dieser Therapie zu profitieren. Nach Zweit- oder Drittlinientherapie sprechen nur ungefähr 20 Prozent der Patienten an. Daher scheint aktuell der richtige Ansatz zu sein, zunächst eine Therapie mit einem Checkpoint-Inhibitor einzuleiten und die weiteren Schritte sind abhängig vom Tumoransprechen. Einige Patienten zeigen ein komplettes Ansprechen (complete response), mit totaler Remission der Tumorerkrankung. Andere Tumore sprechen teilweise an (partial response), häufig zeigt sich eine Tumorreduktion von 70 Prozent, was immer noch eine gutes Therapieansprechen ist. Viele dieser Patienten entwickeln eine stabile Erkrankung, die sie in der Lebensqualität nicht einschränkt. Eine Frau, die ich vor kurzem behandelt habe, hatte über ein Jahr eine partial response und entwickelte im weiteren Verlauf eine complete response. Wenn das Medikament wirkt, erfolgt in der Regel ein schnelles Tumoransprechen, welches weit über ein Jahr anhält. Allerdings sind wir unsicher was passiert, wenn die Therapie beendet wird.
Auch wenn Chemotherapien nicht mehr als standardmäßige Erstlinientherapien gesehen werden können, kann eine Strahlentherapie weiterhin in einigen Fällen zu Beginn der Behandlung von Vorteil sein. Diese ergänzt sich gut mit den Immuntherapien. Für das Immunsystem ist es einfacher kleine Tumoren zu bekämpfen als Große und die Strahlentherapie kann einen Tumor effektiv schrumpfen lassen. So kann man, wenn möglich, die größten Tumorherde zunächst bestrahlen, um eine Reduktion der Tumorlast zu erzielen, und im Anschluss eine Therapie mit einem Checkpoint-Inhibitor einleiten. Das Immunsystem kann dann effektiver die kleineren Tumorherde bekämpfen.
Frage: Wie sieht es mit den anderen, für das Melanom zugelassenen, Checkpoint-Inhibitoren, Nivolumab (Opdivo) und die Kombination mit Ipilimumab (Yervoy) –Nivolumab, aus? Werden diese Medikamente auch beim Merkelzell-Karzinom ausprobiert?
Antwort: Bisher gibt es keine veröffentlichten Daten mit diesen Medikamenten beim Merkelzell-Karzinom. Es gibt jedoch aktuell eine klinische Studie, mit der Kombinationstherapie Ipilimumab und Nivolumab, die Patienten rekrutiert. Obwohl offizielle Daten fehlen, gibt es Einzelfallberichte über einzelne Patienten, die ein gutes Therapieansprechen unter diesen Medikamenten zeigten.
Frage: Wie sehen die nächsten Schritten aus, wenn die Checkpoint-Inhibitoren nicht wirken?
Antwort: Dies ist aktuell von großem Interesse und Gegenstand der Forschung. Unterschiedliche Immuntherapien zu kombinieren ist ein wichtiges, noch zu erforschendes, Gebiet. Ein weiterer Ansatz ist die Möglichkeit einer Kombination von intraläsionalen Injektionen mit immun-stimulierenden Medikamenten und systemischen Immuntherapien. Des Weiteren gibt es Überlegungen zur Kombination von Chemotherapien oder Strahlentherapien mit Checkpoint-Inhibitoren, allerdings gibt es hierzu noch keine Daten aus klinischen Studien und wir wissen nicht, ob dies gut funktionieren würde.
Frage: Sie haben gesagt, dass Sie bei etwa der Hälfte der Patienten ein gutes Therapieansprechen unter einem Checkpoint-Inhibitor erwarten würden. Dies würde bedeutet, dass die andere Hälfte nicht von der Therapie profitiert. Gibt’s es die Möglichkeit im Voraus herauszufinden, welche Patienten von der Therapie profitieren, da es sich um eine teure Therapie mit einigen durchaus schwerwiegenden Nebenwirkungen handelt? Damit man, bei den möglichen Nicht-Ansprechern, eine für sie besseren Therapie einleiten kann.
Antwort: Obwohl mehr als die Hälfte der Patienten auf die Therapie ansprechen, schreitet bei ungefähr 40 Prozent der Patienten die Tumorerkrankung fort, als ob sie keine Therapie bekommen würden. Leider können wir aktuell nicht im Voraus sagen, welche Patienten auf eine Immuntherapie gut ansprechen werden und welche nicht. Wir und viele andere Gruppen arbeiten sehr hart an der Lösung dieses Problem, aber bisher sind die dutzend durchgeführten Tests nicht viel genauer als das Werfen einer Münze.
Frage: Wie wäre es, wenn man einen Zyklus einer Therapie verabreicht hat? Gibt es einen Weg zu einem frühen Zeitpunkt herauszufinden, ob die Tumorerkrankung wiederkommt?
Antwort: Wir haben in diesem Bereich spannende Fortschritte gemacht. Unsere Arbeitsgruppe hat einen Bluttest entwickelt, der nach bestimmten Merkelzell-Polyomavirus-Antikörpern im Blut sucht. Er dient dazu das Wiederauftreten der Tumorerkrankung frühzeitig erkennen zu können, wenn der Tumor noch besser zu behandeln ist (siehe www.merkelcell.org/sero).
Drs. Patrick Moore und Yuan Chang fanden im Jahr 2008 heraus, dass die meisten Merkelzell-Karzinome zum Teil durch ein Virus mitverursacht werden. (Zudem spielt Sonnenlicht eine häufige Rolle.) Wir finden das Merkelzell-Polyomavirus in etwa 80 Prozent der Merkelzell-Karzinome. Wenn dieses Virus Zellen infiziert, produziert es Onkogene (krebserzeugende Proteine), die dazu führen können, dass Zellen unkontrolliert wachsen können. Wir machen diesen Bluttest zu unterschiedlichen Zeitpunkten. Beginnend mit der Diagnosestellung, wenn die Anzahl der Antikörper gegen das Polyomavirus-Protein im weiteren Verlauf steigt, ist dies ein starkes Indiz auf das Fortschreiten der Tumorerkrankung.
Wir verwenden den Bluttest aktuell routinemäßig, denn er ist sehr hilfreich zur Verlaufskontrolle von Patienten über einen längeren Zeitraum. Etwa die Hälfte der Patienten produzieren keine dieser Antikörper, und diese Patienten haben ein etwa 40-prozentig höheres Risiko, dass ihre Merkelzellkarzinom wiederkehrt als Patienten, die die Antikörper produzieren. Daher wissen wir, dass wir diese Pateinten engmaschig mit bildgebenden Verfahren beobachten müssen. Bei Patienten, bei denen wir Antikörper nachweisen können, ist es relativ einfach: Wenn der Krebs nicht fortschreitet, fallen die Antikörper schnell ab. In den meisten Fällen sind sie ein Jahr nach der Behandlung nicht mehr nachweisbar. Wenn das Merkelzell-Karzinom wieder auftritt, steigen die Antikörper an. Hierdurch bekommen wir die Chance ein erneutes Auftreten der Tumorerkrankung frühzeitig zu entdecken, wenn es gut zu behandeln ist: Die Behandlung einer Traube, anstelle einer Grapefruit (in Bezug auf die Tumorgröße,) macht einen großen Unterschied. Hinzu kommt, dass bei einem Patienten mit fallenden Antikörpern, uns der Bluttest große Sicherheit gibt, dass der Krebs nicht zurückgekehrt ist. In diesem Fall können teure bildgebende Verfahren ausgesetzt oder reduziert werden.
Etwa zwei Dutzend Klinken/Zentren im Land nutzen den Test bereits und eine Arbeitsgruppe in Europa entwickelt einen ähnlichen Test. Die ersten Daten zu unserem Bluttest wurden im Jahr 2010 veröffentlicht. Durch die Unterstützung einer NIH-Förderung (National Institutes of Health) konnten wir nun mehr als 200 Patienten mit einem neu diagnostizierten Merkelzell-Karzinom über einen gewissen Zeitraum beobachte, um zu sehen, wie nützlich dieser Test ist. Wir und unsere Patienten haben in der Tat den Test als sehr hilfreich empfunden. Die zweite große Validierungsstudie wird Ende 2016 in der Fachzeitschrift Cancer erscheinen.
Frage: Wenn Sie einen Patienten mit einem Merkelzell-Karzinom behandelt haben, wie entscheiden Sie in welchen Abständen die Patienten zur Nachsorge kommen müssen und wie ihr jeweiliges Risiko ist?
Antwort: Seit einigen Jahren haben wir umfangreiche Daten darüber, wie lange Patienten in verschiedenen Stadien nach der Erstdiagnose des Merkelzell-Karzinoms leben. Aber erst seit kurzer Zeit gibt es Daten darüber, ob und wann die Tumorerkrankung wieder aufgetreten ist. Zu meiner Überraschung haben sich die Daten als unglaublich nützlich erwiesen. Zum Beispiel, wenn ein Merkelzell-Karzinom diagnostiziert wird, können Sie dem Patienten sagen, dass bei 70 Prozent der Patienten im Stadium 3 ein Rezidiv auftritt. Im Vergleich hierzu besteht das Risiko bei Patienten in einem frühen Stadium 1 nur bei 20 Prozent. Aufgrund der neuen Daten über das rezidivfreie Überleben („recurrence-free survival“) ist es möglich, den Patienten bei ihrer Nachsorgeuntersuchung nach einem Jahr eine Aussage darüber zu geben wieviel „Restrisiko“ sie haben. Wenn die Tumorerkrankung nach drei Jahren nicht wiederkehrt, ist der Großteil des Risikos verschwunden.
Darüber hinaus sollte man wissen, dass das Stadium bei Erstdiagnose auch zum Zeitpunkt des Wiederauftretens der Tumorerkrankung eine wichtige Rolle bei der Einschätzung der Schwere der fortschreitenden Tumorerkrankung spielt. Patienten mit einem Stadium 1 bei Erstdiagnose entwickeln in der Regel beim erneuten Auftreten der Erkrankung Metastasen, die in der Nähe des Primärtumors lokalisiert sind oder eventuell in den Lymphknoten. Diese können gut behandelt werden. Wenn im Gegensatz hierzu, Patienten mit einem Stadium 3 ein erneutes Auftreten der Tumorerkrankung entwickeln, sind oft Metastasen in anderen Organen vorhanden und diese sind deutlich gefährlicher.
All diese Daten lagen uns vor 6 Monaten noch nicht vor und sie sind sehr hilfreich in der Beurteilung, wie engmaschig eine Nachsorge der Patienten in den unterschiedlichen Stadien erfolgen sollte. Möglicherweise erfolgte bisher die Nachsorge in zu kurzen Abständen und über zu viele Jahre.
Insgesamt gehen wir aktuell davon aus, dass wir die Patienten nicht so engmaschig über eine so lange Zeit nach beobachten müssen, wie wir es bisher getan haben. Es sieht nicht so aus als würden Merkelzell-Karzinome sich wie Melanome verhalten, die oft auch noch nach fünf oder zehn Jahren nach Erstdiagnose metastasieren. Bei Merkelzell-Karzinomen kommt es in der Regel innerhalb von zwei bis drei Jahren nach Erstdiagnose zu einer Metastasierung. Von daher gehen wir zum jetzigen Zeitpunkt davon aus, dass eine engmaschige Nachsorge für zwei oder drei Jahre sowie eine anschließende Nachsorge in größeren Abständen bis zu etwa fünf Jahren, in der Regel angemessen ist. Da die Daten über die rezivifreie (recurrence-free) Zeit noch nicht veröffentlicht sind, sind sie unter https://merkelcell.org/prognosis/disease-recurrence/ verfügbar.
Frage: Gibt es auch andere neue Therapiemöglichkeiten die einen solchen Unterschied machen?
Antwort: Die Checkpoint-Inhibitoren haben die Wende gebracht. Keine der bisher untersuchten Therapien konnte diesen Unterschied zeigen. Aktuell verwenden wir virus-spezifische T-Zellen des Patienten in Kombination mit den Checkpoint-Inhibitoren, um gegen den Tumor anzukämpfen. In virus-induzierten Merkelzell-Karzinomen können diese T-Zellen einfach ausfindig gemacht werden, entfernt und mit einem Wachstumsfaktor versehen werden, der ihre Lebensdauer verlängert und sie besser Tumorzellen töten lässt. Im Anschluss werden diese veränderten T-Zellen wieder in den Patienten injiziert. Dies gibt dem Immunsystem einen Schub und in Kombination mit den Checkpoint-Inhibitoren sind diese beiden Therapien gegebenenfalls effektiver, als alleine.
Wir sind außerdem auf der Suche nach intraläsionalen Therapien, die mit den Checkpoint-Inhibitoren kombiniert werden können. Dies sind Immuntherapien, wie Interferon, Interleukin-12 oder toll-like-Rezeptoragonisten, die direkt in den Tumor gespritzt werden. In Studien mit einer geringen Anzahl von Patienten mit Merkelzell-Karzinomen konnte gezeigt werden, dass durch diese Medikamente die injizierten Metastasen kleiner geworden oder komplett verschwunden sind. Des Weiteren konnten einige weiter entfernte Metastasen im Körper verkleinert werden. Es werden aktuell Studien durchgeführt und es sieht so aus, dass einige dieser “lokalen” Immunstimulatoren in Kombination mit den Checkpoint-Inhibitoren zu einer besseren Ansprechrate führen, als bei alleiniger Gabe der Checkpoint-Inhibitoren.