Questions-réponses avec Paul Nghiem, MD, PhD

La Skin Cancer Foundation s'est entretenue avec Paul Nghiem, MD, PhD, des progrès décisifs dans la détection, le suivi et le traitement des patients atteints du carcinome à cellules de Merkel (MCC), un cancer de la peau rare mais dangereux. Le Dr Nghiem (prononcé NEE-em) est titulaire de la chaire dotée George F. Odland et directeur du département de dermatologie de l'Université de Washington à Seattle. Il est l'un des plus grands experts du MCC aux États-Unis
Questions et réponses
Q : Le mélanome tue plus de personnes que toute autre forme de cancer de la peau. Mais alors que le carcinome à cellules de Merkel (MCC) est beaucoup plus rare que le mélanome, il est plus dangereux au cas par cas. Qu'est-ce qui le rend plus dangereux ?
R : Les MCC précoces sont généralement beaucoup moins visibles que les mélanomes précoces. Ils ne semblent pas inquiétants, ils finissent donc souvent par être détectés à un stade plus avancé, lorsqu'ils se sont métastasés (se sont propagés) à d'autres parties du corps et sont plus difficiles à guérir. En revanche, de nombreux mélanomes se trouvent en fait au stade in situ (stade 0), lorsqu'ils sont contenus dans la couche supérieure de la peau (épiderme) et n'ont pas envahi les couches plus profondes. Ces mélanomes in situ sont faciles à traiter et n'ont pratiquement aucune chance de métastaser. Mais sur plus de 1,000 XNUMX cas de MCC que nous suivons, nous n'avons eu que deux lésions in situ. Il est très rare de les détecter aussi tôt.
Lorsque vous trouvez un mélanome ou une tumeur MCC pour la première fois, la première préoccupation est de savoir si les cellules tumorales peuvent avoir métastasé de la lésion (la tumeur primaire) aux ganglions lymphatiques les plus proches. Le moyen standard de vérifier cela aujourd'hui est le biopsie du ganglion sentinelle (SLNB). Dans ce test, le médecin vérifie qu'aucune cellule cancéreuse ne s'est propagée aux ganglions lymphatiques en retirant et en examinant au microscope les premiers ganglions voisins qui reçoivent le drainage lymphatique de la tumeur primaire. Avec le mélanome, dans la plupart des cas, la tumeur est petite et à un stade suffisamment précoce pour que vous n'ayez pas besoin de faire une GSNB car il est très peu probable qu'elle ait métastasé. Cependant, même le plus petit MCC, aussi petit que quatre ou cinq millimètres de diamètre, a 15% de chances de s'être propagé aux ganglions lymphatiques ou au-delà, nous envisageons donc de faire un SLNB même si un MCC est très petit.
Q : Que peuvent faire les gens pour découvrir davantage de ces lésions lorsqu'elles sont facilement curables ? Comment peuvent-ils reconnaître les MCC potentiels plus tôt ?
R : Les signes ABCDE classiques du mélanome ne fonctionnent pas pour le carcinome à cellules de Merkel. Au lieu de cela, nous avons l'acronyme, A E I O U, ce qui peut aider à une reconnaissance précoce : Asymptomatique/manque de sensibilité ; Eexpansion rapide ; Isuppression immunitaire; Oplus de 50 ans ; et Upeau claire/exposée aux ultraviolets. Environ 63 % des patients atteints de MCC présentent des lésions à expansion rapide et près de 90 % présentent au moins trois des caractéristiques AEIOU. Il est important de noter, cependant, que de nombreuses lésions présentant plusieurs des caractéristiques AEIOU ne s'avèrent pas être des MCC - certaines sont bénignes et d'autres peuvent être un cancer de la peau différent.
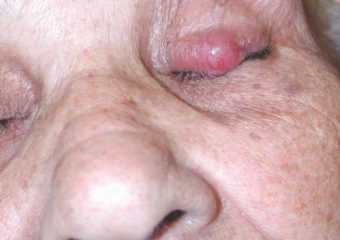
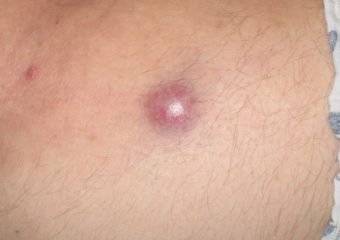
Photos avec l'aimable autorisation de Paul Nghiem, MD, PhD
Q : Une fois qu'un CCM s'est métastasé dans les ganglions lymphatiques ou au-delà, quelles sont les chances de survie du patient ?
R : C'est difficile à dire en ce moment, car grâce aux nouveaux traitements, la survie s'améliore rapidement. J'avais l'habitude de me sentir désespéré si quelqu'un développait un MCC métastatique, mais maintenant ce n'est clairement pas désespéré. Il y a eu des changements majeurs dans le domaine, avec une réelle possibilité de guérison ou de quasi-guérison pour le MCC avancé. Je pense maintenant qu'au moins la moitié des patients atteints de MCC métastatique seront traités efficacement.
Q : Quels traitements ont fait la différence ?
R : Dans le passé, nous traitions le carcinome à cellules de Merkel avancé par chimiothérapie. Cette approche réduirait les tumeurs dans plus de la moitié des cas, mais le bénéfice ne durerait que trois mois en moyenne. Lorsque le cancer est réapparu, il était résistant à de nombreux médicaments et le système immunitaire avait été supprimé par la chimiothérapie, aggravant les problèmes de ce qui est un cancer très sensible au système immunitaire. Cependant, les inhibiteurs de point de contrôle sont une nouvelle classe passionnante d'immunothérapies (traitements qui renforcent la capacité du système immunitaire à combattre une maladie) et sont devenus la norme de soins pour le MCC avancé. En bloquant les récepteurs protéiques qui contrôlent normalement le système immunitaire, ces médicaments stimulent les lymphocytes T pour combattre la tumeur.
En mars 2017, la Food and Drug Administration (FDA) des États-Unis a approuvé un médicament immunostimulant, l'avelumab (Bavencio), pour le traitement des patients adultes et pédiatriques de 12 ans et plus atteints de MCC métastatique. L'approbation de la FDA, la toute première pour le MCC avancé, était basée sur les données d'un essai clinique dans lequel 33 % des patients ont subi un rétrécissement complet ou partiel de leurs tumeurs, même s'ils avaient tous déjà reçu une chimiothérapie pour leur MCC. Des études ultérieures sur l'avelumab ont montré des taux de réponse plus élevés lorsqu'il est administré en tant que traitement de « première intention » (avant la chimiothérapie), avec environ 50 % des patients qui en bénéficient.
Injecté par voie intraveineuse, l'avélumab stimule les cellules T en bloquant une molécule appelée PD-L1 (programmed death-ligand 1) qui se lie à PD-1 pour inhiber ces cellules immunitaires critiques.
En 2018, le pembrolizumab (Keytruda) approuvé par la FDA pour le traitement du MCC, après une étude portant sur des patients atteints d'un CCM récurrent localement avancé ou métastatique qui n'avaient pas reçu précédent la thérapie systémique pour la maladie a montré un 56 pour cent objectif taux de réponse (ORR).
En 2023, la FDA accordé une approbation accélérée à rétifanlimab-dlwr, aussi un PD-1 inhibiteur, comme traitement pour adultes avec métastatique ou récidivante localement avancéed CMC. Son sla sécurité et l'efficacité étaient basées sur les données de l'essai POD1UM-201 qui évaluait le traitement chez les adultes atteints d'un CCM métastatique ou récurrent localement avancé qui n'avaient pas reçu de traitement systémique antérieur pour la maladie. Ces patients ont montré un ORR de 52 %.
J'avais l'habitude de me sentir sans espoir pour les patients atteints de MCC métastatique. Maintenant, ce n'est clairement pas désespéré.
Q : Y a-t-il un ordre préféré dans lequel les traitements doivent être administrés maintenant ? Devez-vous d'abord administrer une chimiothérapie ou une radiothérapie avant d'utiliser l'une des thérapies de blocage des points de contrôle ?
R : Jusqu'à récemment, la chimiothérapie était le traitement de première ligne. Mais si vous traitez un MCC avancé avec un inhibiteur de point de contrôle avant de faire une chimiothérapie, environ 60 % des patients répondent. Si vous attendez que le patient ait échoué à un cycle de chimiothérapie, il semble qu'environ 40 % des patients répondent. Et après deux cycles de chimiothérapie ou plus, environ 20 % des patients répondent. Donc, généralement, la bonne approche semble maintenant être d'utiliser d'abord le médicament immunostimulant, puis de décider quoi faire ensuite en fonction de la réponse. Certains patients auront une réponse complète, avec une rémission totale de la maladie. Les tumeurs de certains patients répondront partiellement, diminuant souvent de 70 % le volume de la tumeur, ce qui reste une réponse majeure. Beaucoup de ces patients finissent par avoir un faible niveau de maladie qui n'affecte en rien leur santé. Une femme que j'ai traitée récemment a eu une réponse partielle pendant un an, puis elle s'est transformée en une réponse complète. Mais généralement, si le médicament fonctionne, la réponse est rapide (en 1 à 2 mois) et la plupart des réponses durent bien plus d'un an. Cependant, nous ne savons pas ce qui se passera lorsque le médicament sera arrêté.
L'avelumab étant désormais approuvé par la FDA pour le MCC traité ou non par chimiothérapie, il est désormais utilisé préférentiellement comme traitement de première intention du MCC métastatique, alors que la chimiothérapie n'est pas privilégiée dans la plupart des cas. Les données actuelles suggèrent que l'immunothérapie fonctionne mieux si elle est administrée avant la chimiothérapie, ce qui tend à supprimer le système immunitaire et à rendre les tumeurs plus résistantes à une variété de traitements.
Bien que la chimiothérapie ne soit plus le traitement de première ligne habituel, la radiothérapie peut dans certains cas être utilisée à bon escient dès le début du match. Il peut parfaitement interagir avec l'immunothérapie. Le système immunitaire réussit mieux à éliminer les petites tumeurs que les grosses tumeurs, et les radiations peuvent réduire efficacement les tumeurs. Si la réponse à l'immunothérapie n'est pas complète, les lésions individuelles qui ne répondent pas peuvent parfois être traitées avec un peu de radiothérapie pour faciliter le travail du système immunitaire.
Q : Qu'en est-il des autres thérapies de blocage des points de contrôle approuvées par la FDA pour le mélanome, nivolumab (Opdivo®) et l'association ipilimumab (Yervoy®)-nivolumab ? Sont-ils également jugés pour MCC?
R : Il existe une quantité croissante de données disponibles sur le fonctionnement de la combinaison « ipi-nivo » dans MCC. Son application principale concerne les patients qui ne répondent pas à un seul agent immunostimulant (avélumab ou pembrolizumab). Pour ces patients « réfractaires », il semble que la combinaison ipi-nivo puisse aider dans environ 20 à -30 % des cas. En revanche, l'ipi-nivo n'est généralement pas utilisé initialement car le taux de réponse d'environ 60 % pour le pembrolizumab ou l'avélumab seul est assez élevé, et l'inclusion de l'ipilimumab (Yervoy) dans l'immunothérapie est bien connue pour ajouter des effets secondaires importants par rapport à un seul PD -1 médicament de la voie (comme l'avélumab ou le pembrolizumab.).
Q : Que se passe-t-il ensuite si aucune des thérapies initiales de point de contrôle ne fonctionne ?
R : Il s'agit d'un vaste domaine d'intérêt et de recherche. Comme indiqué ci-dessus, la combinaison « ipi-nivo » peut aider dans environ 20 à -30 % des cas de MCC qui ne répondent pas à une seule thérapie de point de contrôle immunitaire. Il est également possible que des injections locales de thérapies immunostimulantes soient associées à un agent systémique tel que l'immunothérapie. D'autres approches à l'étude consistent à donner aux patients des cellules T tueuses génétiquement optimisées spécifiques au cancer, semblables aux cellules « CAR-T » qui se sont avérées bénéfiques pour certains cancers du sang.
Q : Vous avez dit que vous vous attendiez à ce qu'environ la moitié des patients réussissent bien les thérapies de blocage des points de contrôle. Cela suggère qu'environ la moitié ne le fera pas. Puisqu'il s'agit de traitements coûteux avec des effets secondaires potentiellement graves, existe-t-il un moyen de savoir à l'avance quels patients en bénéficieront, afin de pouvoir commencer les non-répondeurs prévus avec un traitement plus bénéfique ?
R : Bien que plus de la moitié des patients répondent, pour environ 40 % des patients, le cancer continue de progresser comme si vous ne leur donniez aucun traitement. Nous et beaucoup d'autres travaillons très dur pour résoudre ce problème, et je suis ravi de dire qu'il y a des progrès dans ce domaine après plus de cinq ans de travail. Il semble que les patients qui ont un bon nombre de lymphocytes T spécifiques du cancer dans leur sang sont beaucoup plus susceptibles de répondre aux inhibiteurs de points de contrôle que ceux qui n'en ont pas. Fait fascinant, le nombre de cellules T spécifiques du cancer dans les tumeurs ne prédit pas la réponse. Pour utiliser une analogie de bataille militaire, il semble que le nombre de troupes efficaces disponibles en renfort (dans le sang) soit critique pour gagner la guerre. En revanche, le nombre que l'on trouve sur le champ de bataille (dans la tumeur), n'est pas important. Ces résultats suggèrent que si nous pouvons augmenter le nombre de lymphocytes T spécifiques du cancer disponibles pour le patient, nous pourrons peut-être l'aider à mieux combattre le cancer.
Q : Qu'en est-il après l'administration d'un traitement ? Existe-t-il un moyen de savoir tôt si le cancer commence à revenir?
R : Nous avons fait des progrès passionnants dans ce domaine. Notre équipe a mis au point un test sanguin qui recherche certains anticorps du polyomavirus à cellules de Merkel dans le sang, afin de détecter précocement d'éventuelles récidives, lorsque la tumeur sera plus efficacement traitable (voir www.merkelcell.org/sero).
En 2008, Patrick S. Moore, MD et Yuan Chang, MD ont découvert que la plupart des carcinomes à cellules de Merkel sont en partie causés par un virus. (La lumière du soleil joue aussi souvent un rôle.) Nous trouvons ce polyomavirus à cellules de Merkel dans environ 80 % des tumeurs MCC. Lorsque ce virus infecte les cellules, il produit des oncoprotéines (protéines favorisant le cancer) qui peuvent entraîner une croissance incontrôlée des cellules. Nous faisons le test sanguin à différents intervalles, en commençant au moment du diagnostic, et si le nombre d'anticorps contre ces protéines de polyomavirus augmente, cela indique fortement que le patient a une récidive.
Nous utilisons maintenant ce test de manière routinière, car il est très utile pour gérer les patients au fil du temps. Environ la moitié des patients ne produisent aucun de ces anticorps, et ils courent en fait un risque environ 40 % plus élevé de récidive de leur MCC que ceux qui fabriquent les anticorps, nous savons donc que nous devons les suivre de près avec d'autres approches. Pour les patients qui fabriquent les anticorps, c'est relativement simple : si le cancer ne réapparaît pas, les anticorps chutent rapidement et, dans la plupart des cas, ils sont indétectables un an après le traitement. Si le MCC revient, les anticorps augmentent. Cela nous donne une grande chance de découvrir les récidives tôt, lorsqu'elles sont extrêmement traitables : Traiter un raisin au lieu d'un pamplemousse (en termes de taille du cancer) fait une grande différence. Et avec un patient dont les anticorps ne cessent de baisser, le test sanguin nous donne une grande confiance que le cancer ne se reproduise pas, nous pouvons donc ignorer ou réduire l'utilisation d'examens d'imagerie coûteux.
À partir de 2022, nous sommes impliqués dans le développement d'un autre test qui détecte les morceaux d'ADN du cancer qui flottent dans le sang. C'est ce qu'on appelle un test « d'ADN tumoral circulant ». Il a été utilisé pour les cancers, notamment du sein et du côlon. Cela semble fonctionner particulièrement bien pour MCC. Un avantage majeur de ce test est qu'il fonctionne même chez les patients qui ne produisent pas d'anticorps contre le virus Merkel. Par conséquent, pratiquement tous les patients atteints de MCC devraient subir un test sanguin généralement plus précis et plus sensible que les analyses corporelles.
Q : Après avoir traité des patients atteints de MCC, comment décidez-vous de la fréquence à laquelle les voir et du risque qu'ils ont encore que le cancer réapparaisse ?
R : En avril 2022 nous avons récemment signalé que le risque global de récidive du MCC est de 40 % ; il s'agit d'un taux significativement plus élevé que les cancers de la peau les plus courants. De plus, il est clair que le stade du cancer d'un patient lors de sa présentation et d'autres facteurs de risque affectent grandement son propre risque de récidive du CCM. Ces facteurs comprennent la suppression immunitaire, le sexe masculin et l'âge avancé, qui augmentent tous le risque de récidive. Étant donné que 95 % des récidives surviennent au cours des trois premières années suivant le diagnostic, le temps écoulé depuis le diagnostic est un facteur très important qui détermine les chances restantes d'un patient que son CCM se reproduise encore. Cela est à son tour très utile pour déterminer le degré d'agressivité avec lequel les patients doivent être suivis.
Nous avons créé un « calculateur de risque » en ligne. qui tient compte de ces différents facteurs. Il est disponible via www.merkelcell.org/recur.
Dans notre pratique quotidienne, cela s'est avéré incroyablement utile. Par exemple, lorsque les patients vous voient pour leur visite de suivi d'un an, il est désormais possible de leur dire quel est le risque « résiduel » de maladie qu'ils ont, par rapport à leur chance juste au début de la surveillance.
En général, nous croyons maintenant que nous n'avons plus besoin de surveiller les patients aussi étroitement pendant autant d'années qu'auparavant. Le MCC ne semble pas être comme le mélanome, qui réapparaît souvent cinq ou 10 ans après le diagnostic. Avec le MCC, s'il revient, c'est généralement dans les deux à trois ans. Ainsi, nous pensons maintenant qu'un suivi intensif pendant deux ou trois ans est généralement approprié, avec un calendrier nettement moins agressif jusqu'à environ la cinquième année.
Q : Y a-t-il d'autres nouvelles formes de traitement qui font une différence ?
R : Les immunothérapies par blocage des points de contrôle ont changé la donne, et aucune autre thérapie testée n'a encore fait ce genre de différence. Cependant, en combinaison avec la thérapie par points de contrôle, nous utilisons maintenant les cellules T des patients pour combattre le cancer. Dans certains cas, nous « reprogrammons » les cellules du patient pour attaquer le cancer en reconnaissant le virus. Dans d'autres cas, nous trouvons et développons leurs propres lymphocytes T spécifiques du virus de Merkel. Cela peut donner un coup de pouce au système immunitaire, et combiner cette thérapie avec une thérapie de blocage des points de contrôle peut être plus efficace que l'une ou l'autre approche seule.
Nous envisageons également de combiner certaines thérapies intralésionnelles avec les thérapies de blocage des points de contrôle. Dans de petites études sur le MCC, ils ont souvent rétréci ou éliminé les tumeurs injectées et réduit certaines autres tumeurs dans tout le corps. Des études sont en cours, mais il semble probable que certains de ces stimulateurs immunitaires «locaux» administrés avec des agents de point de contrôle immunitaire aideront à produire des taux de réponse plus élevés que les agents de point de contrôle administrés seuls.
Publié le 7 novembre 2016. Mis à jour le 21 septembre 2022.
