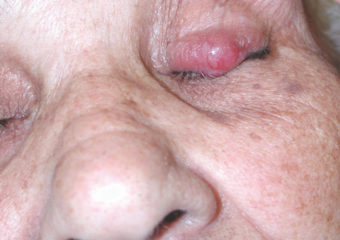
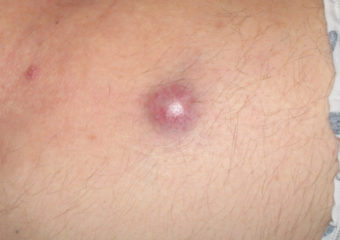
Intervista con il Paul Nghiem, MD, PhD

D: Il melanoma uccide più persone di qualsiasi altra forma di tumore della pelle. Il carcinoma a cellule di Merkel (MCC) è molto più raro del melanoma, ma più pericoloso caso per caso. Cosa lo rende più pericoloso?
R: MCC precoci sono in genere molto meno frequenti dei melanomi precoci. Non sembrano interessare, così finiscono spesso per essere diagnosticati in una fase più avanzata, quando hanno metastatizzato (diffusione) in altre parti del corpo e sono molto più difficili da curare. Al contrario, molti melanomi sono effettivamente diagnosticati nella fase in situ (stadio 0), quando sono contenuti nello strato superiore della pelle (epidermide) e non hanno invaso gli strati più profondi. Questi melanomi in situ sono facili da trattare e non hanno praticamente alcuna possibilità di metastasi. Ma su più di 1.000 casi di MCC che stiamo seguendo, abbiamo avuto solo due lesioni in situ. È molto raro riuscire a diagnosticarli in una fase cosi precoce.
Quando viene diagnosticato un melanoma o un tumore MCC, la preoccupazione iniziale è se le cellule del tumore hanno metastatizzato dalla lesione (tumore primario) ai linfonodi più vicini. Il modo standard di controllare questo oggi è la biopsia del linfonodo sentinella (SLNB). In questo test, il medico verifica che nessuna cellula tumorale si sia diffusa ai linfonodi più vicini, rimuovendo ed esaminando al microscopio pochi dei linfonodi nelle vicinanze che per primi ricevono fluido linfatico dal tumore primario. Con il melanoma, nella maggior parte dei casi, il tumore è piccolo e in una fase precoce non è necessario fare un SLNB dato che è improbabile che abbia metastatizzato. Tuttavia, anche il più piccolo MCC, anche di 4 o 5 millimetri di diametro, ha una probabilità del 15 per cento di avere coinvolto i linfonodi o altri tessuti, quindi consideriamo utile eseguire SLNB anche se MCC è molto piccolo.
D: Cosa si può fare per scoprire più frequentemente queste lesioni quando sono facilmente curabili ? Come si può diagnosticare un MCC in fase più precoce?
R: I classici segni di ABCDE del melanoma non funzionano per il carcinoma a cellule di Merkel. Invece, abbiamo l’acronimo AEIOU che può aiutare con il riconoscimento iniziale: Asintomatico/mancanza di tenerezza; Espansione rapida; Immunosoppressione ; Più di 50 anni; e Esposizione ai raggi UV/pelle chiara. Circa il 63 per cento dei pazienti con MCC hanno lesioni in rapida espansione e quasi il 90% ha tre o più delle caratteristiche AEIOU. È importante notare, tuttavia, che molte lesioni con alcuni segni AEIOU non sono MCC — alcuni sono tumori benigni, altri potrebbero essere un tumore della pelle di natura differente.
D: Se MCC ha metastatizzato ai linfonodi o oltre, qual’è la percentuale di sopravvivenza dei pazienti?
R: Al momento è difficile dirlo poiché, grazie ai nuovi trattamenti, la sopravvivenza sta migliorando rapidamente. Ero solito sentirmi senza speranza per i pazienti con MCC metastatico. Ora, chiaramente, non è più cosi. Ci sono stati grandi progressi in questo campo, con una concreta possibilità di cura anche per MCC avanzati. Ora so che almeno la metà dei pazienti con MCC metastatico sono trattati in modo efficace.
D: Quali trattamenti hanno fatto la differenza?
R: In passato, abbiamo trattato il carcinoma a cellule di Merkel avanzato con la chemioterapia. Questo approccio sembra aver ridotto i tumori in oltre la metà dei casi, ma il beneficio durava in media soltanto 3 mesi. Al momento della recidiva il tumore risultava resistente a molti farmaci, e il sistema immunitario era stato soppresso dalla chemioterapia, aggiungendo problemi per quello che è un tumore decisamente immuno-sensibile. Tuttavia, i “checkpoint inhibitors”, gli inibitori di checkpoint sono una nuova categoria di immunoterapie (trattamenti che aumentano la capacità del sistema immunitario di combattere una malattia), e stanno rapidamente diventando lo standard di cura per MCC avanzati. Bloccando i recettori di proteine che normalmente mantengono il sistema immunitario in stato di controllo, questi farmaci stimolano le cellule T a combattere il tumore. Nel 2014, un farmaco inibitore di checkpoint chiamato pembrolizumab (Keytruda R), che blocca il recettore della proteina chiamato PD-1 (morte programmata-1), è stato originariamente approvato per combattere il melanoma avanzato, consentendo di mettere molti tumori in remissione a lungo termine. Ora viene utilizzato con successo off-label (per uno scopo differente da quello per cui è stato approvato) in studi clinici su MCC e viene presa in considerazione l’approvazione ufficiale per l’utilizzo in MCC.
Al momento nessun farmaco è mai stato approvato per il trattamento di MCC dalla Food and Drug Administration americana (FDA). Gli studiosi stanno anche testando una nuova terapia di blocco checkpoint chiamata avelumab su pazienti MCC. Esso stimola le cellule T bloccando una molecola chiamata PD-L1 che agisce insieme con PD-1 per inibire queste importanti cellule immunitarie.
Sono in corso su pazienti MCC diverse sperimentazioni di ogni farmaco, e in base al successo ottenuto fino ad oggi, essi diventeranno sempre più disponibili. Nel 2015, la FDA ha assegnato ad Avelumab lo stato di “fast track”, “percorso veloce” e di “terapia dell’innovazione” per accelerare la sua sperimentazione e la sua probabile approvazione ufficiale. Pensiamo che sia pembrolizumab che avelumab saranno approvati per MCC nel 2017, visto che diventa sempre più chiaro che questi farmaci sono notevolmente più efficaci e sicuri della chemioterapia tradizionale.
“Ero solito sentirmi senza speranza per i pazienti con MCC metastatico. Ora, chiaramente, non è più cosi.”
D: Quale dei due farmaci ha avuto i migliori risultati?
R: È Impossibile dirlo perché i farmaci sono stati testati in diverse popolazioni di pazienti (nessuna precedente chemioterapia per pembrolizumab e nessun successo dalla precedente chemioterapia per avelumab). Entrambi i farmaci bloccano lo stesso meccanismo generale per far rivivere/stimolare le cellule T, quindi al momento attuale non c’è alcuna chiara differenza di efficacia tra questi farmaci.
D: In quale ordine preferenziale devono essere somministrati i trattamenti in questo momento? Dovete comunque eseguire come primo passo la chemioterapia o la radioterapia prima di utilizzare una delle terapie di blocco checkpoint?
R: Fino a poco tempo fa, la chemioterapia è stata la terapia di prima linea. Ma se si tratta un MCC avanzato con un inibitore di checkpoint prima di fare la chemioterapia, circa il 60 per cento dei pazienti risponde positivamente. Se si tratta un paziente che ha eseguito senza successo un ciclo di chemioterapia, la percentuale di risposta si riduce al 40 per cento. E dopo due o più cicli di chemioterapia, tutti senza successo, la percentuale scende ancora al 20 per cento. Così, attualmente, l’approccio giusto sembra essere utilizzare l’agente di blocco checkpoint come primo passo, poi decidere cosa fare successivamente sulla base della risposta clinica.
Alcuni pazienti avranno una risposta completa, con la totale remissione della malattia. Altri pazienti avranno una risposta parziale, comunque con una diminuzione del 70 per cento della massa tumorale, che è già una risposta importante. Molti di questi pazienti finiscono per avere un basso livello di malattia che non condiziona assolutamente la loro qualità di vita. Una donna che ho trattato recentemente ha avuto una risposta parziale per un anno, poi successivamente una risposta completa. Ma di solito, se il farmaco entra a regime, la risposta è evidente e la maggior parte delle risposte permane per oltre 1 anno. Tuttavia, non sappiamo ancora cosa accade alla sospensione del farmaco. Anche se non è più la chemioterapia il trattamento usuale di primo attacco, la radioterapia può in alcuni casi essere usata a buon vantaggio nelle prime fasi del tumore dato che agisce in buona sinergia con l’immunoterapia. Il sistema immunitario è più efficace nell’eliminare tumori di piccole dimensioni mentre le radiazioni possono efficacemente ridurre i tumori di grandi dimensioni. Quindi, si può decidere di irradiare le lesioni più grandi prima di utilizzare la terapia di blocco checkpoint. Il sistema immunitario può quindi agire in maniera più efficace per eliminare tumori di piccole dimensioni.
D: Che cosa ci può dire riguardo alle altre terapie di blocco checkpoint approvate dalla FDA per il melanoma, nivolumab (OpdivoR) e la combinazione ipilimumab (YervoyR)-nivolumab? Possono essere sperimentate anche per MCC?
R: Non ci sono dati pubblicati su questi farmaci nella terapia di MCC, anche se sta iniziando un nuovo studio clinico sulla combinazione di ipilimumab e nivolumab Mancano dati ufficiali, ma abbiamo osservato risultati incoraggianti su diversi pazienti trattati con questi farmaci.
D: Cosa succede se nessuna delle terapie checkpoint funziona?
R: Questa al momento è un’area di enorme interesse e ricerca. La combinazione di due tipi differenti di farmaci immuno-stimolanti è una grande area da esplorare. È anche possibile che le iniezioni locali di terapie immuno-stimolanti per eliminare un tumore target-specifico potranno essere combinate con un agente sistemico come un’immunoterapia. C’è anche interesse a coniugare la chemioterapia o radioterapia con le terapie di blocco di checkpoint, ma queste strade non sono ancora state studiate e non sappiamo bene quanto possano funzionare.
D: Lei ci ha detto che si aspetta che circa la metà dei pazienti possa trarre beneficio dalle terapie di blocco checkpoint. Questo suggerisce che l’altra metà non lo faccia. Poiché questi sono trattamenti costosi con alcuni effetti collaterali potenzialmente gravi, c’è il modo di sapere in anticipo quali pazienti potranno trarne beneficio in modo che il paziente non-responder possa iniziare con un trattamento più favorevole?
R: Anche se più della metà dei pazienti risponde, circa il 40 per cento circa dei pazienti sembra non reagire affatto alle cure, quasi come se non stesse effettuando alcuna terapia. Purtroppo, attualmente non possiamo dire in anticipo chi risponderà e chi no. Stiamo lavorando con molto impegno per cercare di risolvere questo problema, ma, fino ad oggi, nessuno dei numerosi test che abbiamo effettuato è più attendibile del lancio di una monetina.
D: Cosa accade dopo che è stato somministrato un ciclo di trattamento ? C’è un modo di prevedere fin dall’inizio se il tumore sta iniziando a tornare?
R: Abbiamo fatto passi avanti emozionanti in questo campo. Il nostro team ha sviluppato un esame del sangue, che evidenzia alcuni anticorpi di poliomavirus in talune cellule di Merkel nel sangue, in modo che possiamo rilevare eventuali recidive presto, quando il tumore sarà trattabile più efficacemente (Vedi www.merkelcell.org/sero).
Nel 2008, i Dottori Patrick Moore e Yuan Chang hanno evidenziato che la maggior parte dei carcinomi a cellule di Merkel sono causati da un virus. (anche la luce del sole svolge un ruolo importante). Troviamo questo polyomavirus delle cellule di Merkel in circa l’80 per cento dei tumori MCC. Quando questo virus infetta le cellule, produce delle oncoproteine (proteine che favoriscono il cancro) che possono indurre le cellule a crescere senza controllo. Facciamo gli esami del sangue a intervalli differenti, a partire dal momento della diagnosi, e se osserviamo un aumento di questi anticorpi anti poliomavirus, sappiamo che il paziente sta iniziando ad avere una recidiva. Ora stiamo usando questo test di routine, perché è molto utile nella gestione dei pazienti in follow up. Circa la metà dei pazienti non produce questi anticorpi, e al momento essi hanno il 40 per cento in più di probabilità di avere una recidiva rispetto ai pazienti che li producono, quindi abbiamo bisogno di seguirli più attentamente con immagini radiografiche. Per i pazienti che producono gli anticorpi il follow up è relativamente semplice: se il tumore non recidiva, gli anticorpi scendono rapidamente e nella maggior parte dei casi non saranno rilevabili prima di un anno dopo il trattamento. Se MCC recidiva, gli anticorpi salgono. E’ molto importante evidenziare al più presto le recidive, quando il tumore è facilmente trattabile: trattare un acino d’uva invece di un pompelmo (in termini di dimensione del tumore) fa una grande differenza. In un paziente in cui gli anticorpi continuano a diminuire, il test del sangue ci dà grande fiducia che il tumore non è recidivante, quindi possiamo evitare o ridurre l’uso di costose scansioni di immagini. Nel nostro paese circa due dozzine di istituzioni stanno utilizzando ora il test, e un gruppo in Europa sta sviluppando un test simile. Abbiamo pubblicato la prima descrizione del nostro test nel 2010. Utilizzando il supporto di una sovvenzione del NIH, abbiamo seguito più di 200 casi recentemente diagnosticati di MCC e vediamo nel tempo quanto è utile questo test. Noi e i nostri pazienti in realtà abbiamo visto che il test sul sangue è molto utile, e i risultati di questo grande studio saranno pubblicati sulla rivista Cancer a fine 2016.
D: Dopo avere trattato i pazienti con MCC, quanto spesso decidete di vederli e che rischio hanno ancora di ricomparsa del tumore?
R: Per diversi anni, abbiamo avuto buoni dati sulla sopravvivenza dei pazienti dopo la diagnosi di MCC in vari stadi, ma solo recentemente abbiamo ottenuto dati sulle eventuali recidive dei pazienti. Con mia grande sorpresa, questo si è dimostrato incredibilmente utile. Ad esempio, quando ai pazienti viene diagnosticato il tumore per la prima volta, si può dire loro che un paziente in fase 3 può avere una probabilità del 70 per cento di avere una recidiva, mentre un paziente in fase 1 può avere solo il 20 per cento di probabilità di una recidiva. Quando i pazienti tornano per la visita di follow-up dopo un anno, è ora possibile dire loro quanto rischio ‘residuo’ di malattia hanno, utilizzando i dati sulla “sopravvivenza libera da recidiva” (quanto a lungo rimane un paziente senza recidiva). Se una lesione non recidiva per 3 anni, la maggior parte del rischio è esaurita.
Inoltre, è importante sapere che, anche quando le lesioni recidivano, è importante considerare la fase in cui è stato diagnosticato il tumore originale Mentre pazienti di stadio 1 possono avere recidive solitamente ancora vicino al tumore primario o, eventualmente, nei linfonodi attigui, i pazienti di stadio 3 possono avere metastasi distanti e molto più pericolose.
Tutti questi dati non erano disponibili fino agli ultimi 6 mesi, e si sta rivelando molto utile sapere quanto strettamente continuare a seguire i pazienti. Fino ad oggi probabilmente abbiamo eseguito controlli troppo aggressivi e per troppi anni.
In generale, ora sappiamo che non dobbiamo monitorare i pazienti così strettamente e per molti anni come eravamo soliti fare. MCC non sembra essere come il melanoma, che recidiva spesso anche dopo 5 o 10 anni dopo la diagnosi. Con MCC, se si ha recidiva essa si presenta solitamente entro 2 o 3 anni. Così, ora sappiamo che è utile effettuare un follow-up intensivo per due o tre anni, mentre esso va ridotto fino al quinto anno. Questi dati non sono ancora pubblicati, ma sono consultabili presso https://merkelcell.org/prognosis/disease-recurrence/.
D: Esistono altre eventuali nuove forme di trattamento che stanno facendo la differenza?
R: Le immunoterapie di blocco checkpoint hanno rivoluzionato il gioco e nessun’altra terapia in fase di test ha dato risultati simili. Tuttavia, in combinazione con la terapia sui checkpoint, ora stiamo usando le cellule T virus-specifiche dei pazienti per combattere il tumore. In MCC virus-guidati, puoi trovare facilmente queste cellule T, rimuoverle e farle crescere con fattori di crescita che li fanno vivere più a lungo e uccidere meglio, poi li riinfondi nel paziente. Questo può dare una spinta al sistema immunitario, e combinando questa terapia con la terapia di blocco checkpoint si può avere un’efficacia maggiore rispetto a ciascun approccio da solo.
Stiamo anche cercando di combinare alcune terapie intralesionali con le terapie di blocco checkpoint. Queste sono le immunoterapie quali l’interferone, l’interleukina-12 o i toll-like receptor che sono iniettati direttamente nei tumori dei pazienti. In piccoli studi su MCC, esse hanno spesso ridotto o eliminato i tumori che erano stati infiltrati e ridotto anche alcuni altri tumori in tutto il corpo. Sono in corso studi, ma sembra probabile che alcuni stimolatori immuni ‘locali’ somministrati insieme con gli agenti immuni checkpoint aiuteranno a suscitare indici di risposta più elevati rispetto alla sola somministrazione di agenti checkpoint.
Pubblicato 2016.