Le Cancer de la Cellule de Merkel
Qu’est-ce que le cancer de la cellule de merkel ?
Le cancer de la cellule de Merkel (CCM) est un carcinome cutané rare et agressif dont le risque de rechute est élevé et dont l’extension métastatique peut se manifester n’importe où. La plupart des rechutes surviennent au cours des deux années suivant la découverte de la tumeur primitive. Alors que cette maladie est 30 fois plus rare que le mélanome (son estimation s’élève à 0,24 cas par 100.000 personnes aux USA), elle tue près d’un malade sur trois.
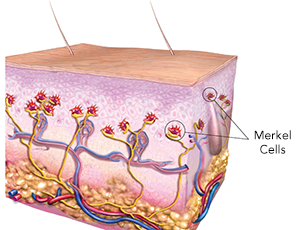
Le CCM survient souvent sur les zones exposées au soleil chez les sujets à peau claire, au-delà de la cinquantaine. Il doit son nom à la proximité de ses cellules cancéreuses avec les cellules normales de Merkel de la peau qui contribueraient à la sensation tactile. Les cellules de Merkel normales ont été décrites depuis plus d’un siècle par Friedrich Sigmund Merkel.
Quelles sont les causes du CCM ?
Immunodépression et CCM sont intimement liés. Les sujets dont le système immunitaire est chroniquement déprimé (patients VIH positifs ou ayant subi une transplantation d’organe exigeant une médication immunodépressive) sont 15 fois plus aptes à développer un CCM que ceux qui ne sont pas immunodéprimés. Le CCM survient à un age nettement plus jeune chez les patients HIV ou transplantés. Enfin 50% des CCM des immunodéprimés apparaissent avant 50 ans.
Des constatations scientifiques indiquent l’existence d’un lien étroit entre CCM et exposition aux ultraviolets. Le CCM est fréquemment associé à un cancer spinocellulaire (CSC), un cancer baso-cellulaire et une maladie de Bowen (une forme superficielle du CSC) qui sont souvent causés par l’exposition habituelles aux UV. Les psoriasiques traités aux UVA et aux psoralènes dont l’effet renforce l’efficacité des premiers présentent une incidence 100 fois plus élevée que la population générale aux CCM.
En fait, l’exposition aux UV déclenche une double peine : non seulement elle endommage la peau, augmentant ainsi le risque de cancer cutané, mais elle déprime également le système immunitaire.
A côté de l’irradiation aux UV, des médicaments prescrits aux transplantés et à l’immunodépression occasionnée par des virus comme le VIH, des maladies auto-immunes comme l’arthrite rhumatoïde et certaines affections malignes, telles que la leucémie lymphoïde chronique ou les lymphomes peuvent également déprimer profondément le système immunitaire chez ces patients dont le risque de mortalité au cours du CCM est 2 fois plus élevé que chez les sujets dont le système immunitaire est normal. Ceci suggère que le système immunitaire limite le développement du CCM et prévient l’extension de la maladie.
En 2008, des scientifiques de l’Université de Pittsburgh ont découvert le “polyomavirus de la cellule de Merkel“, un virus humain présent dans approximativement 80% des CCM alors qu’il n’existe que dans moins de 10% des mélanomes et des autres cancers cutanés. La plupart des gens ont déjà été exposés aux polyomavirus (membres d’une famille de virus ADN à double brins) à l’âge de 20 ans. Quand le polyomavirus de la cellule de Merkel infecte une cellule, il produit des protéines qui peuvent entrainer une croissance cellulaire non contrôlée produisant le cancer. Cependant environ 20% des CCM ne recèlent pas ce virus ce qui indique que sa présence passagère ou permanente n’est pas indispensable dans la production du CCM. De plus, la plupart des gens ont ce virus toute leur vie sans développer obligatoirement un CCM. Il est possible qu’une fois au contact du virus, le sujet peut subir l’influence d’autres facteurs comme l’exposition aux UV et l’immunodépression pour déclencher le CCM.
Cancer à cellules de Merkel – Facteurs de risque et signes d’alarme
Ils comprennent :
- l’âge, au-dessus de 50 ans (en sachant que la majorité des patients a dépassé 70 ans) ;
- le sexe, masculin ;
- peaux claires ;
- expositions aux UV naturels ou non ;
- immunodépression.
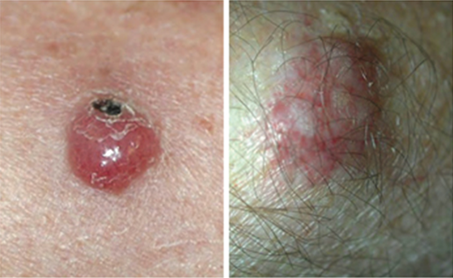
Les CCM sont habituellement curables s’ils sont détectés rapidement et à un stade précoce. Toutefois, comme ils sont souvent agressifs et peuvent évoluer rapidement, leur diagnostic précoce suivi d’une excision chirurgicale sont d’une importance extrême. Ces tumeurs apparaissent habituellement comme des lésions fermes, indolores ou des nodules sur des régions photo-exposées (dans 48% des cas sur la tête, la nuque et fréquemment les paupières). Typiquement elles sont rouges, bleues, violacées ou encore de la couleur de la peau. Leur taille varie mais, habituellement, leur diamètre est inférieur à 20mm. Leur diamètre lors de la détection est en moyenne de 17 mm (<2 cm stade 1a). Il est indispensable que vous et votre médecin soyez à l’affût de tous ces signes et de leur changement comme celui d’autres lésions cutanées. Ceci est encore plus important si le patient a déjà présenté un CCM, traité, et dont la cicatrice vous intrigue.
Certains médecins utilisent l’acronyme AEIOU (cinq de nos six voyelles) pour résumer la somme des facteurs à prendre en considération pour détecter une lésion naissante précocement :
- A Asymptomatique
- E Extension rapide
- I Immunodépression
- O…AU-delà de 50 ans
- U Exposition aux UV et peau claire
Carcinome à cellules de Merkel (stades)
Certains médecins recommandent spécifiquement une technique appelée “Biopsie du ganglion sentinelle” pour les patients atteints de CCM quelles que soient les dimensions de la tumeur pour déterminer si elle a gagné les ganglions lymphatiques.
Très faiblement invasive, avec un minimum de risque d’effets adverses, cette technique est très importante pour déterminer le pronostic car à partir des ganglions lymphatiques les cellules peuvent facilement inonder les vaisseaux lymphatiques, passer dans la circulation générale et envahir l’organisme. Ces ganglions sont de petits nodules situés dans le système lymphatique où se forment les lymphocytes (globules blancs) et qui filtre la lymphe (liquide incolore contenant des globules blancs et qui draine les tissus au moyen des vaisseaux lymphatiques dans le torrent circulatoire).
Que se passe-t-il au cours de la biopsie du ganglion sentinelle ?
- Pour pratiquer une telle biopsie, l’équipe médicale commence par identifier (en les localisant) les nodules lymphatiques en utilisant une technique connue sous le nom de lymphoscintigraphie ou de cartographie lymphatique. On injecte un marqueur radioactif et/ou un colorant bleu au siège de la tumeur, puis le marqueur et le colorant voyagent dans le système lymphatique emportant les vaisseaux de la tumeur vers l’aire lymphatique correspondante. Un instrument qui détecte le marqueur cartographie le chemin emprunté par la tumeur vers le ganglion sentinelle, de un à trois nodules dans le territoire ganglionnaire. Les cellulaires cancéreuses émanant de la tumeur suivront probablement la même voie.
- Le chirurgien extrait le ganglion sentinelle qu’on adresse au laboratoire, à la recherche de cellules anormales.
- Si la biopsie révèle leur existence, le chirurgien procède alors à un curage ganglionnaire de la région, ou dans certains cas, préconise la radiothérapie.
Bénéfices de la biopsie du ganglion sentinelle
L’attitude du corps médical n’est pas unanime sur la nécessité de pratiquer une biopsie du ganglion sentinelle et de procéder au curage ganglionnaire régional. Toutefois, on pense que le marquage des lymphatiques et du ganglion sentinelle sont utiles pour des raisons importantes. En effet :
- le marquage identifie la région où le cancer à cellules de Merkel a la plus grande probabilité de se montrer invasive.
- le ganglion sentinelle biopsié révèle des micrométastases invisibles à l’œil nu et non détectables par les examens physiques standards. Les résultats de la biopsie du ganglion sentinelle permettent de déterminer un pronostic : en cas de négativité, les patients ont environ 80% de chances de survivre 5 ans, en cas de positivité, les patients n’ont que 50% de chances de survie dans les 5 ans.
- Les résultats de la biopsie permettent également d’évaluer le stade d’évolution du cancer et de décider l’instauration d’un autre traitement.
- Le curage ganglionnaire et/ou la mise en œuvre d’un traitement radiothérapique prévient les rechutes locales.
Stades du carcinome à cellules de Merkel
Une fois que les tests précédemment indiqués ont été évalués (y compris les images photographiques et le bilan sanguin), les oncologistes évalueront le stade de la maladie. Les différents stades tiennent compte de plusieurs facteurs :
- épaisseur de la tumeur, ulcération, vitesse de croissance (indice mitotique)
- si le cancer a atteint les ganglions lymphatiques, combien de ganglions sont touchés ?
- si les cellules cancéreuses sont allées au-delà des ganglions vers des destinations lointaines, quelles régions et quels organes ont été la cible ?
Le choix des traitements dépend directement du stade atteint par le cancer. Il n’existe pas de score universel pour le CCM mais, actuellement, la classification utilisée est celle du Comité américain.
Le système TNM du Comité sur le cancer (AJCC) où T représente la tumeur primitive, sa taille, sa vitesse de croissance et d’autres facteurs ; N indique l’envahissement des ganglions locaux et l’extension ganglionnaire et M, les métastases à distance. L’AJCC comporte 4 stades :
- Stade 0 : tumeurs in situ (tumeurs superficielles restées épidermiques) ;
- Stade I à II : tumeurs dont on n’a pas détecté des ganglions locaux, le stade I comprenant des tumeurs relativement petites et à faible risque (diamètre <2mm : 1a ; diamètre >2 mm : 1b) ; le stade II indiquant des tumeurs plus importantes et/ou à risque plus élevé ;
- Stade III : tumeurs qui ont gagné l’aire des ganglions lymphatiques locaux, mais sans la dépasser ;
- Stade IV : métastases à distance atteignant d’autres aires ganglionnaires ou des organes lointains.
Les limites de chaque stade oscillent entre le risque le plus faible et le plus élevé en fonction des caractéristiques de la tumeur primitive, des métastases ganglionnaires et/ou des métastases à distance.
—
Si le cancer s’est étendu à l’aire ganglionnaire locale, le chirurgien procède en général à un nettoyage de la région ou à son irradiation, diminuant ainsi le risque de récidive et prévenant dans une certaine mesure des métastases à distance. Mais dans la plupart des cas, les patients qui ne présentent pas d’atteinte ganglionnaire objective ne doivent pas être soumis à la recherche du ganglion sentinelle pour vérifier si les cellules cancéreuses ont gagné l’aire ganglionnaire locale. Toutefois, contrairement à d’autres cancers, les CCM peuvent avoir atteint les ganglions lymphatiques proches ou bien les ont dépassé lorsque le diagnostic a été posé qu’ils soient détectables ou non à l’examen physique. Même une petite tumeur a environ 30% de chances d’avoir envahi les ganglions alors que, par comparaison, les chances d’essaimage ganglionnaire d’un mélanome qu’on vient de détecter sont seulement de 1%.
Les résultats qu’apporte la biopsie du ganglion sentinelle sont importants dans la mesure où ils déterminent le pronostic et guident le traitement. Si le test est négatif aucun traitement supplémentaire n’est nécessaire. S’il est positif, on procède le plus souvent à un curage ganglionnaire et, fréquemment, à une irradiation de la région. En fonction des résultats des examens ultérieurs, d’autres traitements également sont susceptibles de jouer un rôle. On recommande en effet une chimiothérapie uniquement pour les patients dont le cancer a envahi des sites éloignés comme le foie ou les poumons. Malgré la multiplicité des traitements les résultats sont variables et souvent limités. De plus, ils s’accompagnent malheureusement d’importants effets secondaires. Aucune étude n’a montré qu’ils prolongeaient la vie des sujets bien qu’ils puissent offrir une courte rémission. Cependant, ces traitements peuvent être utilisés pour réduire ou éliminer des lésions spécifiques, diminuer la douleur et augmenter le confort et la mobilité du patient.
Le blocage thérapeutique des points de rencontre immunitaires
Récemment, les chercheurs ont obtenu un de leurs plus grands succès réalisé à ce jour dans le traitement du stade IV du cancer de la cellule de Merkel avec l’utilisation d’une immunothérapie dénommée Checkpoint blockade therapy (blocage thérapeutique des points de rencontre immunitaires).
En mars 2017 la FDA (USA) a validé le ″Checkpoint blockade therapy″ concernant un médicament l’avelumab (spécialisé sous le nom de Bavencio) pour le traitement d’adultes et de jeunes patients de 12 ans et plus, atteints de cancer à cellules de Merkel (CCM). L’autorisation de la mise sur le marché, la première jamais formulée pour le traitement des formes avancées du CCM s’appuyait sur les données d’un essai clinique où 33% patients avaient obtenu une disparition totale ou partielle de leurs tumeurs.
Le ″checkpoint blockade immunotherapy″ bloque certaines molécules qui inhibent ou contrôlent la production de cellules T, afin de prévenir les réactions excessives et potentiellement dangereuses, inflammatoires et auto-immunes, pour les ramener dans des conditions normales. En bloquant ces molécules inhibitrices, les traitements réalisent des vagues de cellules T qui attaquent le CCM.
L’avelumab bloque le ″death-ligand 1 (PD1-L1)″programmé, une molécule qui se lie à une autre molécule appelée PD1.En bloquant le ″death-ligand 1 (PD-L1) l’avelumab l’empêche de se lier à PD1, par relargage de cellules T pour détruire le CCM. Dans l’essai clinique avec l’avelumab l’efficacité s’est manifestée pendant plus de 6 mois chez 86% des patients qui répondaient au traitement, et plus de 12 mois chez 45% de ceux qui réagissaient favorablement à celui-ci.
Un autre ″check point blockade therapy″ le pembrolizumab (spécialisé sous le nom de Keytruda) a également prouvé des résultats expérimentaux prometteurs chez les sujets atteints de CCM et serait en voie de validation par la FDA. Le pembrolizumab avait été préalablement reconnu par la FDA comme efficace dans le traitement des formes avancées de mélanome en prolongeant la durée de vie des malades de plusieurs années et leur procurant de longues périodes de rémission.
Le pembrolizumab bloque la molécule PD1 immuno- inhibitrice et déverse également des vagues de cellules T qui attaquent les cellules cancéreuses.
Dans une petite étude récente de 26 cas de CCM avancés, 14 (56%) ont réagi positivement au traitement avec 4 patients en rémission complète. La majorité des patients répondant favorablement au traitement recelaient le polyomavirus des cellules de Merkel, suggérant que les antigènes viraux peuvent avoir majoré la réponse thérapeutique.
Bien que cette étude ne fût pas destinée à déterminer spécifiquement si le pembrolizumab pouvait bloquer les polyomavirus du CCM, les résultats ont montré que le traitement y parvenait et des travaux vont être entrepris pour confirmer si ce traitement, comme d’autres, cible efficacement le polyomavirus.
Le 30 Mai 2017, une équipe de chercheurs de l’Université Fred Hutchinson et de l’Université de Washington à Seattle ont rapporté les succès thérapeutiques au cours d’une petite étude associant l’avelumab à deux autres traitements (transfert de cellules T autologues) et irradiations, ou bien une autre immunothérapie, l’interféron).
Trois parmi les quatre patients atteints de CCM métastatiques (stade 4) traités par cette association expérimentale sont en rémission complète avec absence de tout signe de cancer.
Au cours du traitement par transfert de cellules T autologues les chercheurs ont extrait des cellules T qui reconnaissent le CCM du sang des patients, les multiplient au Laboratoire et les réinjectent pour stimuler leur attaque contre les cellules du CCM. Lorsqu’on ajoute l’avelumab on accélère le processus
Une étude préalable sur quatre patients associant le traitement par transfert des cellules T et l’irradiation ou l’interféron, mais sans l’association d’avelumab n’a pas été bénéfique, la maladie progressant chez trois des patients, deux décédés depuis.
Directives de Prévention
Un déficit immunitaire contribue de façon majeure au développement du CCM, il est donc important d’adopter un mode de vie saine et tout mettre en œuvre pour conserver un système immunitaire efficace. C’est ainsi qu’il est indispensable d’éviter une surexposition aux U.V., surtout si le patient a déjà présenté un CCM ou si un de ses proches a eu cette affection ou une autre variété de cancer cutané.
Voici des règles de vie indispensables :
- rechercher l’ombre, en particulier entre 10h et 16h ;
- ne pas prendre de coup de soleil ;
- éviter le bronzage et les bancs solaires ;
- protection vestimentaire, chapeau à large bord, lunettes anti U.V. ;
- utiliser des crèmes antisolaires à large spectre (UVA/UVB) avec un SPF 15 et au-delà, tous les jours, en répétant les applications. Pour ceux qui ont une activité à l’extérieur, utiliser une crème antisolaire avec un SPF 30 et au-delà, résistant à l’eau ;
- appliquer l’équivalent de 2 cuillères à soupe de crème antisolaire sur tout le corps 30 min. avant de sortir. Recommencer toutes les 2 heures ou immédiatement après avoir nagé ou après transpiration excessive ;
- tenir les nouveau-nés à l’abri du soleil. Les crèmes antisolaires doivent être appliquées au-delà du 6e mois ;
- examiner votre peau de la tête aux pieds ;
Voir un dermatologiste une fois/an pour un examen attentif de votre peau. Pour les patients qui ont déjà présenté un CCM, le suivi, après traitement, se limite à une fois par mois pendant 6 mois, puis tous les 3 mois pendant les 2 années suivantes, et tous les 6 mois par la suite.